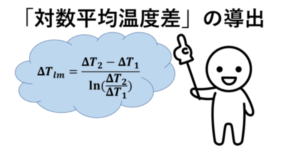こんにちは。化工見習いです!
化学工学技士(基礎)の練習問題を随時ここに更新しようと思うので、過去問が解き終わって暇な方のみぜひトライしてみてください!
※あくまで練習問題で、対策問題ではないので、質は保証できません。。
また、詳しい解答は時間があれば作ります。

自作なので、あまり求めないで!笑
選択肢無し、電卓アリで解いてみて!答えは「+」ボタンを押して確認!
小問集合-○×
①圧縮因子とは\(\displaystyle z=\frac{PV_m}{RT}\)で表される、無次元量である。
②温度差\(\ ΔT_1\),\(\ ΔT_2\)が0以上の実数の時、算術平均温度差と対数平均温度差を比べると、前者の方が常に大きい。
③標準燃焼エンタルピーとは「ある標準状態の単体を1molの酸素で燃焼させたときのエンタルピー変化」である。
④物質Aについての反応速度が\(\ -r_A=kC_A\)で表される場合、この反応は一次反応である。
⑤エントロピー変化の求め方は\(\ ΔS=Q/T\)である。
⑥重力場におけるストークスの終末沈降速度は、粒子径\(\ D_p\)の3乗に比例する。
⑦Fanning式によると圧力損失[Pa]は\(\displaystyle ΔP=4f\frac{v^2}{2}\frac{L}{D}\)で求められる。
⑧砂糖と塩では、砂糖の方がモル質量が大きいため、同じモル数だけ溶媒に加えると砂糖の方が凝固点降下度が大きい。
⑨大気圧において、エタノール-水系は共沸するが、エタノール-ベンゼン系は共沸しない。
② ×・・・\(\ ΔT_1=ΔT_2\)の時、算出平均温度差=対数平均温度差となる。
③ ×・・・正しくは「ある標準状態の単体1molが酸素で燃焼させたときのエンタルピー変化」である。
④ ○
⑤ ×・・・エントロピー変化を\(\ ΔS=Q/T\)で表せるのは、QがTに依存しない場合のみ。
⑥ ×・・・2乗に比例する。
⑦ ×・・・密度が必要。
⑧ ×・・・束一的性質より、同じモル数を添加すれば、物質が違えど凝固点は同じだけ下がる。
⑨ ×エタノール-ベンゼン系も共沸する。
⑩
量論
原子量はH=1,N=14,O=16とし、気体はすべて理想気体とする。
問.1 25 ℃での窒素分子の密度[kg/m^3]を求めよ。
問.2 水素ガスと酸素ガスをモル比1:5で混合させて混合ガスSを得た。この混合ガスSの比熱[J/kg・K]を求めよ。水素分子と酸素分子の比熱をそれぞれCp,h[J/kg・K],Cp,o[J/kg・K]とする。
問.2 \(\displaystyle \frac{Cp,h+80Cp,o}{81}\)
問.3
熱力学
問.1 理想気体の断熱変化において、\(\ PV^{①}=一定\)である。この①は②と呼ばれ、③と④の比をとったものである。また、マイヤーの関係式では\(\ ④-③=⑤\)と示されており、これらから、④と③をそれぞれ①と⑤を用いて表すと、\(\ ④=⑥×⑤\),\(\ ③=⑦×⑤\)となる。
② ポアソン比
③ 定容モル熱容量
④ 定圧モル熱容量
⑤ \(\ R\)
⑥ \(\displaystyle \frac{\gamma}{\gamma-1}\)
⑦ \(\displaystyle \frac{1}{\gamma-1}\)
問.2 \(\ PV^{m}=一定\)(\(\ 1<m<{\gamma}\))である変化を①変化という。この①変化において、圧力を16倍にすると、体積は②倍になる。②が0.1のとき、m=③である(ただしlog2=0.3とする)。また、m=③の場合で圧力を10倍にすると、温度は④倍になる。
② \(\displaystyle ({\frac{1}{16}})^{1/m}\)
③ 1.2
④ 1.47
伝熱論
問1. 対流伝熱の伝熱量\(\ Q=hAΔT\),伝導伝熱の伝熱量\(\displaystyle Q=\frac{kA}{L}ΔT\)である。空気1|壁|空気2の熱移動を考える。左から順に\(\ T_1\)(空気1バルク温度),\(\ T_2\)(空気1側の壁面温度),\(\ T_3\)(空気2側の壁面温度),\(\ T_4\)(空気2バルク温度)とする(\(\ T_1>T_2>T_3>T_4\))。
このとき定常状態で空気1,2と壁との熱伝達率\(\ h_1\),\(\ h_2\),壁の長さ\(\ L\),壁の熱伝導率\(\ k\),伝熱面積はすべて\(\ A\)とすると、伝熱量\(\ Q=①=②=③\)と表せる。これより、\(\displaystyle T_1-T_4=\frac{Q}{A}×④\)と表すことができ、④は全体の熱抵抗を意味する。
② \(\displaystyle \frac{kA}{L}(T_2-T_3)\)
③ \(\ h_2A(T_3-T_4)\)
④ \(\displaystyle \frac{1}{h_1}+\frac{L}{k}+\frac{1}{h_2}\)
問.2
反応工学
A→Bの液相反応について。
問.1 Aの反応速度は\(\displaystyle -r_A=-\frac{dC_A}{dt}=kC_A^{n_A}\)で表されるとする。\(\ n_A=0,1,2\)での半減期\(\tau\)の初期濃度\(\ C_{A0}\)依存性についてそれぞれ求めよ。
問.2 反応速度定数\(\ k\)(単位は1/s)の逆数がちょうど時刻tと同じになるときの濃度\(\ C_A\)を\(\ C_{A0}\)を用いて表せ。
問.3 PFRにAを流入させ、反応させた。\(\ n_A\)は0以上の整数として、空間時間\(\ \tau\)を転化率\(\ x_A\),\(\ k\),\(\ C_{A0}\)を用いて表せ。
\(\ n_A=1\)のとき、\(\displaystyle \tau=\frac{ln2}{k}\)より、\(\tau\)は\(\ C_{A0}\)に依存しない。
\(\ n_A=2\)のとき、\(\displaystyle \tau=\frac{1}{kC_{A0}}\)より、\(\tau\)は\(\ C_{A0}\)に反比例。
問.2 \(\ C_A=e^{-1}C_{A0}\)
問.3 \(\ n_A\)=1のとき、\(\displaystyle \tau=-\frac{ln(1-x_A)}{k}\)
\(\ n_A\)=1でないとき、\(\displaystyle \tau=\frac{C_{A0}^{1-n_A}}{k(n_A-1)}((1-x_A)^{1-n_A}-1)\)
物質移動論
問.1 2成分系において物質の液相モル分率と、気相モル分率の関係を\(\displaystyle y_A=\frac{\alpha_{AB}x_A}{1+({\alpha_{AB}}-1)x_A}\)と表せる時(\(\ \alpha_{AB}>1\))、この\(\ \alpha_{AB}\)を①という。また成分A,Bが純粋で存在するときの飽和蒸気圧\(\ P_A^*\)と\(\ P_B^*\)を用いて\(\displaystyle ①=\frac{②}{③}\)とも表すことができる。分離条件(塔底組成,塔頂組成,原料組成)を固定すると、より\(\ \alpha_{AB}\)が大きい方が分離必要段数は④(多く・少なく)なる。
② \(\ P_A^*\)
③ \(\ P_B^*\)
④ 少なく
問2. A(低沸点成分),B(高沸点成分)の2成分を混合して常圧蒸留すると、低沸点成分であるAが①から、高沸点成分であるBが②から得られる。この2成分系を蒸留すると、液相組成と気相組成が同じになるような組成が見つかった。この現象を③という。この③組成における沸点が、A,B成分の沸点より低い場合、この系を④系といい、逆にA,Bの沸点より高い場合、この系を⑤系という。④では、③組成よりA成分が少ない組成液を原料として多段蒸留すれば、③組成の混合物が⑥から、⑦(AorB)が⑧から得られる。
② 塔底
③ 共沸
④ 最低共沸
⑤ 最高共沸
⑥ 塔頂
⑦ A
⑧ 塔底